Fabricação
A próxima geração
em biomanufatura
Nosso processo é o que nos define
Na Amgen, somos especializados no processo frequente e altamente especializado de desenvolver anticorpos monoclonais in vitro, escalonar a linhagem celular ideal repetidamente em biorreatores de larga escala e verificar duplamente a consistência entre lotes.4,5
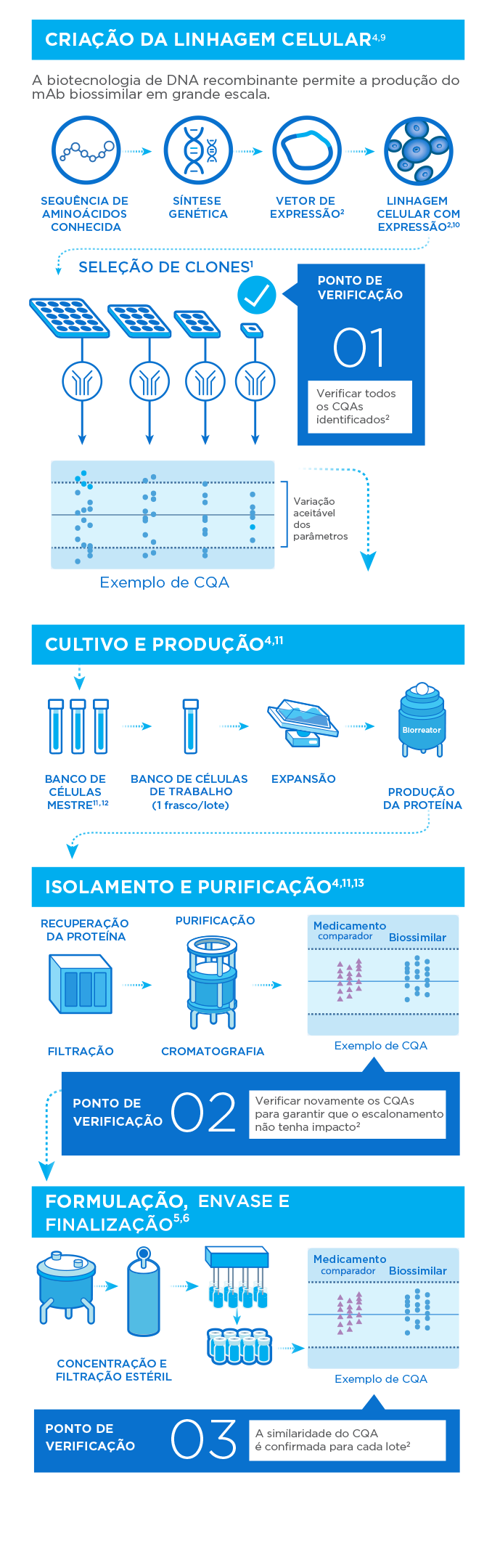
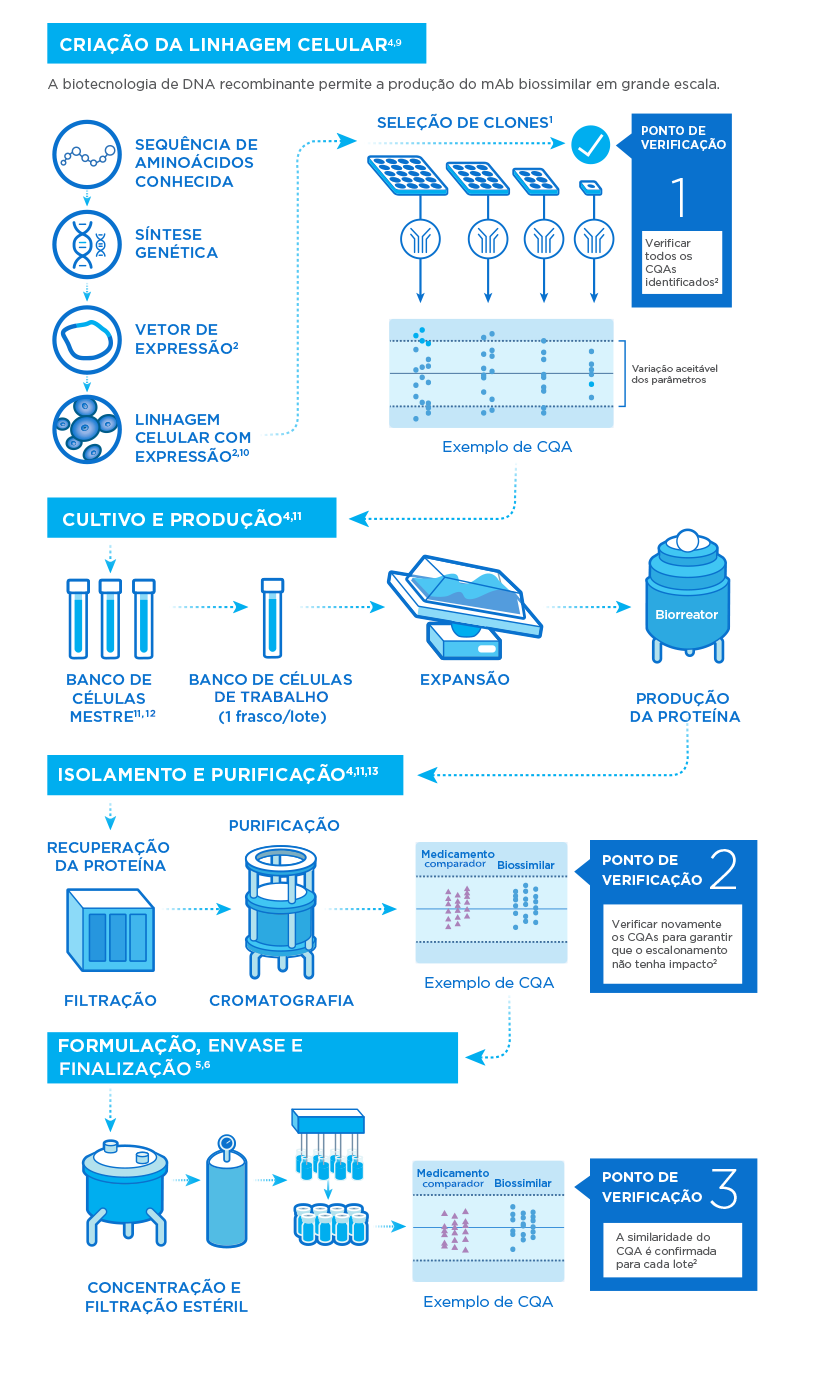
Engenharia de um biossimilar
Com base nos atributos de qualidade críticos (CQAs) de um medicamento biológico comparador, um biossimilar é elaborado de maneira a ser altamente similar em termos das proteínas da célula hospedeira, atributos do produto, variantes, impurezas do processo e perfil de estabilidade.
Caracterização e estudos comparativos
A elevada similaridade em dados analíticos e farmacocinética/farmacodinâmica entre o medicamento biológico de referência e o biossimilar indica um risco menor de diferenças clínicas.
Padrões de qualidade na produção
Rigorosos padrões de qualidade por todo o processo de produção e abrangentes avaliações de risco garantem a segurança e a eficácia do produto.
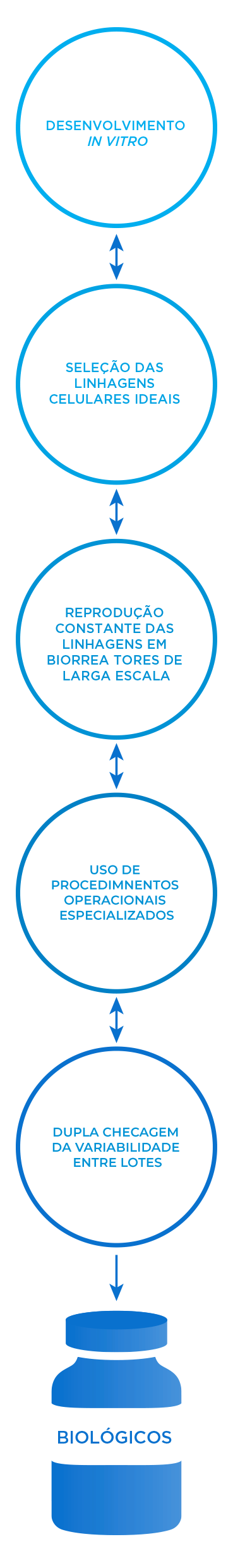
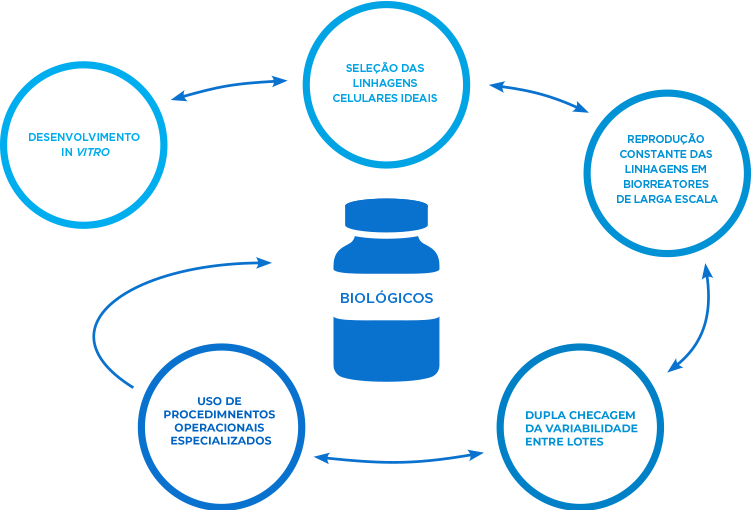
Medicamentos originados de células vivas
Nossos medicamentos biológicos são produzidos usando células vivas desenvolvidas para produzir proteínas terapêuticas em grandes quantidades. Essas células são muito sensíveis a condições geradas durante sua síntese e manuseio, e uma série de etapas de cultivo e purificação é necessária para produzir um ingrediente ativo consistente de alta qualidade.8
Um extenso processo de triagem é utilizado, consistindo nas seguintes etapas
- Desenvolvimento da linha de processo
- Expansão celular
- Coleta
- Purificação (múltiplas etapas)
- Inativação Viral/remoção
- Envase
- Finalização
- Embalagem e armazenamento
- Garantia de qualidade e caracterização
- Testes de Estabilidade
Complexidade na fabricação de biossimilares
Todas as complexidades da fabricação de medicamentos biológicos também se aplicam aos medicamentos biossimilares. Entretanto, o desenvolvimento de um biossimilar também tem seu próprio conjunto de complexidades.
References: 1. Kozlowski S. US FDA perspectives on biosimilar biological products. Presented at: 2014 Biotechnology Technology Summit; June 13, 2014; Rockville, MD. www.ibbr.umd.edu/sites/default/files/public_page/Kozlowski%20-%20Biomanufacturing%20Summit.pdf. Accessed January 10, 2019. 2. US Food and Drug Administration. Guidance for Industry: Quality Considerations in Demonstrating Biosimilarity of a Therapeutic Protein Product to a Reference Product. www.fda.gov/downloads/drugs/guidances/ucm291134.pdf. Published April 2015. Accessed December 21, 2018. 3. US Food and Drug Administration. Guidance for Industry: Scientific Considerations in Demonstrating Biosimilarity to a Reference Product. www.fda.gov/downloads/drugs/guidances/ucm291128.pdf. Published April 2015. Accessed December 21, 2018. 4. Desanvicente-Celis Z, Gomez-Lopez A, Anaya JM. Similar biotherapeutic products: overview and reflections. Immunotherapy. 2012;4:1841-1857. 5. Ramanan S, Grampp G. Drift, evolution, and divergence in biologics and biosimilars manufacturing. BioDrugs. 2014;28:363-372. 6. Bee JS, Randolph TW, Carpenter JF, Bishop SM, Dimitrova MN. Effects of surfaces and leachables on the stability of biopharmaceuticals. J Pharma Sci. 2011;100:4158-4170. 7. Conner J, Wuchterl D, Lopez M, et al. The biomanufacturing of biotechnology products. In: Shimasaki C, ed. Biotechnology Entrepreneurship: Starting, Managing, and Leading Biotech Companies. Waltham, MA: Academic Press; 2014:351-385. 8. Lybecker KM. The biologics revolution in the production of drugs. Fraser Institute. www.fraserinstitute.org/studies/biologics-revolution-in-the-production-of-drugs. Accessed January 10, 2019. 9. Dranitsaris G, Amir E, Dorward K. Biosimilars of biological drug therapies. Drugs. 2011;71:1527-1536. 10. Liu HF, Ma J, Winter C, Bayer R. Recovery and purification process development for monoclonal antibody production. mAbs. 2010;2:480-499. 11. Mellstedt H, Niederwieser D, Ludwig H. The challenge of biosimilars. Ann Oncol. 2008;19:411-419. 12. Roger SD. Biosimilars: how similar or dissimilar are they? Nephrology. 2006;11:341-346. 13. Hesse F, Wagner R. Developments and improvements in the manufacturing of human therapeutics with mammalian cell cultures. Trends Biotechnol. 2000;18:173-180.